转载|真实世界研究在医药领域的应用及研究方法
人工智能在新药研发中的应用现状与挑战
秦雪妮 1,陈维生 2,邵华 3,廖俊 4*
(1. 中国药科大学基础医学与临床药学学院,江苏 南京 211198;2. 南京从一医药科技有限公司,江苏 南京 210000;3. 东南大学附属中大医院药学部,江苏 南京 210009;4. 中国药科大学理学院,江苏 南京 211198)
[摘要]近年来,随着医学研究多样化证据的需求增加和大数据、人工智能技术的支持,真实世界研究成为世界学术界和产业界关注的焦点。为充分认识真实世界研究在医药领域的应用情况,并探究真实世界研究方法的差异和难点,结合 PubMed、中国知网已发表的文献,按临床问题、药品问题、中医药问题三方面应用情况分类,并对其中使用的研究设计、样本量大小、统计分析等方法进行归纳总结,讨论研究中的注意事项并提供了解决办法,以期使真实世界研究发挥最大效用。
作为循证医学金字塔顶端的随机对照临床试验(randomized controlled trial,RCT)一直以来都是评价医疗产品安全性和有效性的“金标准”,但其严格的筛选条件、单一的干预措施、有限的样本控制、昂贵的研究成本等特点 [1],使得 RCT 结果的外推性受限,脱离了真实世界环境。随着医学的发展和科技的进步,人们对于疾病的认识和理解不断加深,多样化证据需求日益增加,传统的 RCT 在长期实践中局限性愈加凸显,科学研究亟待新的模式。
真实世界研究 [real world study(RWS),也称real world research(RWR)] 的概念最早是在实用性随机对照试验(pragmatic clinical trial,PCT)的基础上提出的,其目的在于评估干预措施的实际效果 [2]。1993 年,Kaplan 等 [3] 在研究雷米普利对高血压治疗效果的论文中正式提出 RWS。近年来,RWS发展迅速,正成为建立临床证据和识别线索的重要途径。其原因主要有三:首先,RWS 具备以真实临床为研究环境、外部效度高、样本量大等众多优势,弥补了 RCT 的不足;其次,在技术上,医药智能设备普及化、电子病历无纸化、医疗信息数据化,以及人工智能、基因测序、药物靶向等技术的迅速发展,为 RWS 的数据来源提供了保障;另外,从政策层面来看,2008 年美国 FDA 启动哨点计划,用电子健康数据对上市后医疗产品的安全性和有效性进行主动监测。2016 年,美国《21 世纪治愈法案》鼓励使用真实证据支持医疗产品和药物的监管决策 [4]。2020 年,我国国家药品监督管理局(National Medical Products Administration,NMPA)先后发布《真实世界证据支持药物研发与审评的指导原则(试行)》、《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》、《真实世界数据用于医疗器械临床评价技术指导原则(试行)》等系列文件,表明了国家对 RWS 的高度重视。
然而,国内外对 RWS 并没有落实明确的定义。NMPA 发布的文件仅指出 [5],“真实世界研究是通过收集真实世界环境中与患者有关的数据(真实世界数据),通过分析,获得医疗产品的使用价值及潜在获益或风险的临床证据(真实世界证据)。”据此定义,RWS 并不是一种特定的研究方法,联系 RWS 的出现和时代背景,至少可以有 2 种理解。其一,RWS 与 RCT 相互补充,RCT 在理想严格的环境下提供医疗产品或药品有效性的证据,而 RWS在真实世界的环境下提供有效性证据,仅从这一点理解,RWS 在研究设计和方法学层面上与传统的临床研究并无差异。其二,结合大数据时代背景,充分理解真实世界数据(real world data,RWD)。美国 FDA 曾于 2019 年明确定义“RWD 是指与患者健康状况相关的和/或提供健康服务过程中产生的数据”[6]。常见的数据来源包括但不限于卫生信息 系 统(Hospital Information System,HIS)、 医保系统、疾病登记系统、国家药品不良反应监测哨点联盟(China ADR Sentinel Surveillance Alliance,CASSA)、组学相关数据库、死亡登记数据库等。RWD 具有大数据的“5V”特性,即大量性(volume)、多样性(variety)、快速性(velocity)、价值性(value)、真实性(veracity),还具有医疗领域特有的隐私性和时序性 [7],考虑到这些,RWS 会结合数据挖掘、机器学习等新技术,使其与以往的研究方式相区分。
基 于 以 上 背 景 和 现 有 经 验, 本 研 究 以“("real world study"[Title/Abstract]) OR ("real worldresearch"[Title/Abstract])”为检索式在 PubMed 中检索得到 1 245 篇全文文献,并统计了各个年份对应的文献发表量,从图 1 可以看出,从 2015 年开始,RWS相关论文发表量呈现逐年上升趋势,2019 至 2020年一年间,文献发表量骤增至 468 篇。本综述收集整理了自 2015 年 1 月 1 日至 2021 年 4 月 1 日发表的共1 151 篇文献,并结合国内外已发表的指导原则,主要从 3 个方面讨论 RWS 在真实环境中的应用和研究方法,并探讨其中的注意事项、提供相关解决建议。

1 以临床问题为导向的研究
目前临床 RWS 通常围绕着疾病的病因、诊断、治疗、预后以及构建临床预测模型等临床问题而展开,研究样本量大、样本来源多、分析方法丰富已成为 RWS 的特色(见表 1)。
1.1 病因研究和诊断研究
病因研究多是研究已知疾病与危险因素之间的关系,从而寻找可能的发病机制,常会涉及多因素的分析。如 Mohammad 等 [8] 开展了一项瑞典的RWS,旨在研究心机梗死的危险因素,短期外部因素可能通过引起不稳定斑块的破裂而触发心肌梗死的发生;该研究回顾性观察全国冠状动脉护理单位登记处(SWEDEHEART)从 1998 年到 2013 年 28 014份病例所述症状首发日期,发现圣诞节和仲夏假日与心肌梗死高风险相关,平安夜最高,复活节或赛事期间无明显风险增加,昼夜节律和近周分析显示清晨和周一风险最高,以上结果在 75 岁以上、有糖尿病和冠状动脉病史的患者中更为显著。
诊断研究则是研究某项新技术或新方法对于某种疾病检出的准确性,以判断其应用价值。Thomas等 [9] 测试了基因图谱在慢性背痛患者队列中诊断轴向性脊柱炎(axSpA)的整体能力,或仅诊断强直性脊柱炎(AS),研究表明在一个真实世界的队列中,基因图谱对于根据 ASAS axSpA 分类标准诊断的患者的早期疾病诊断作用有限,种族和疾病异质性混淆了 AS 相关基因对疾病发展的贡献。
1.2 治疗性研究
治疗性研究主要是围绕某种治疗方案对特定疾病产生的疗效和不良反应的研究,也是最常见的临床研究。以真实世界数据为基础开展的大多 RWS在研究设计和研究方法上并无明显差异,例如评估治疗组组间差异时,单变量两样本计量资料常用 t检验,多样本计量资料常用方差分析;单变量计数资料常用卡方检验、Fisher 精确检验。双变量资料分析时常用相关分析方法或回归分析方法 [10]。但由于真实世界数据来源于真实环境,使得存在量级大、数据混杂等众多因素影响着结局事件,因此,除了基础的描述性分析,常需进行控制混杂的分析方法以及敏感性分析。其中最常见的是倾向性评分方法。
1983 年,Rosenbaum 等 [11] 首次提出了倾向性评分的概念。在生物医学研究中,倾向分数经常被用来比较治疗方法,如手术与非手术、药物治疗和非药物治疗等,也可以用来估计任何非随机因素之间的关系 [12]。倾向评分 [e(xi)] 定义为在给定一组观察到的协变量条件(xi)下,观察对象 i(i=1,......N)接受某种处理(或暴露)(zi=1)的条件概率(Pr),即 e(xi) = Pr(zi = 1| xi)。如金标准的随机对照试验中,由于分组是完全随机化的,不受自身特征变量的影响,因此在 1∶1 对照中,患者纳入暴露组或非暴露组的概率是相同的,即倾向值评分为 0.5。而在非随机对照试验中,如常见的观察性研究,研究对象各自混杂因素在组间分布并不均衡,具有特定特征或表型的患者更可能被纳入到处理组,从而使得每个研究对象分到处理组的概率不同。使用倾向分数调整后可消除抽样过程中组间不平衡现象,目前有 4 种用于估计倾向分数的常用调整方法 [12],包括倾向评分匹配(propensity score matching)、倾向评分分层法(stratification)、倾向分数协方差调整(covariate adjustment)、倾向分数逆概率加权法(inverse probability of treatment weighting)。
Medeiros 等 [13] 在 2015 年开展了 RWS,分析老年急性髓性白血病的治疗模式,对治疗组、强化治疗组和不治疗组这 3 组进行倾向评分匹配,再分层处理后进行生存分析,并选用多项逻辑回归计算倾向评分,对配对后的变量采用 Cox 比例风险回归模型分层从而消除组间的异质性。Blonde 等 [14] 在比较卡格列净(canagliflozin)和达格列净(dapagliflozin)对 2 型糖尿病患者血糖控制情况时,同样先进行倾向评分匹配,其采用多变量逻辑回归模型计算倾向值后,进行最近邻 1∶1 匹配(nearest neighbor 1∶1matching),以最小化卡格列净 300 mg 和达格列净10 mg 组之间的选择偏差。可见,同样的倾向评分方法,混杂不同,调整方法也会有所区别,需要注意的是,倾向评分所控制的混杂因素必须是已知的,未知的混杂因素倾向性评分并不能解决 [15];另外,在使用倾向评分匹配方法时,样本量会减少,尤其是原本样本量不大的研究,可能会影响结果的可信度。
1.3 预后研究
预后研究是对疾病发展的不同结局可能性的预测以及对可能的影响预后的因素进行研究。在预后研究中,常常需要记录观察对象在各个时间点上终点事件的发生情况,包括终点事件是否出现以及观察对象达到终点所经历的时间长短等,因此常用生存分析统计分析方法。Jude 等 [16] 使用生存分析中Cox 比例风险模型回顾性评估强化治疗对基础胰岛素控制不佳的 2 型糖尿病(T2D)患者在治疗后 6个月、12 个月糖化血红蛋白(HbA1c)的变化。从健康改善网络(THIN)数据库中识别出使用基础胰岛素控制血糖不佳的患者,记录每例患者首次未达到最佳控制的 HbA1c 发生率的日期作为指数 1;对于强化治疗的患者,强化治疗的日期被记录为指数 2。采用汇总统计和未调整/调整混合模型重复测量(MMRM)估计计算指数为 2 后两组间 HbA1c变化的差异。校正后的逻辑回归分析用于比较指数2 后 12 个月达到目标 HbA1c 的患者比例,Cox 比例风险模型用于描述达到 HbA1c 目标的时间。最后发现,患者在强化治疗 6 个月后其 HbA1c 显著降低,而在 12 个月时几乎没有额外的临床益处。血糖监测控制对糖尿病患者并发症的负担有着重要影响,生活质量和预期寿命都与之息息相关,该 RWS 将会为临床医师提供信息,对血糖控制欠佳的 T2D 患者提供强化治疗的最佳时机。

1.4 临床预测模型
临床预测模型旨在寻找疾病诊断或预后的最佳预测指标,主要分为诊断预测模型和预后预测模型。临床预测模型的分析方法常分为 5 步:模型选择、预测变量处理、多因素分析、拟合校准模型、评估模型 [17]。模型选择取决于临床问题和数据特性,广泛使用的除了传统的线性模型,还有机器学习模型,如贝叶斯网络、支持向量机、随机森林等。预测变量处理主要指按照研究目的对数据的标准化、降维、聚类等处理,以便于后续的统计分析。多因素分析的目的是特征选取,可以通过文献搜索、专家讨论等方式加以确定。最后建立的模型还需要呈现展示,如建立网页、列线图、评分系统、计算器工具等。举例来说,2018 年 Jaja 等 [18] 开发和验证了一套实用的预测工具,可以评估颅内动脉瘤破裂后蛛网膜下腔出血(SAH)的预后,该研究汇集来自多个地理区域的前瞻性观察研究、医院登记和 SAH 随机临床试验的数据集,采用逻辑回归分析模型,根据格拉斯哥预后量表评分(Glasgow outcome scale)预测了 3 个月死亡率或功能预后风险,模型精度使用AUC 曲线来评估,并进行了内部和外部的双重验证,最后基于预测模型开发了可以在线使用的 SAHIT 预后计算器(http://sahitscore.com)和相关应用程序作为辅助工具来支持对患者的管理。
2 以药品问题为导向的研究
近年来,业界越来越期望可以通过科学合理的RWS 来产生真实世界证据,从而满足药品全生命周期中药物研发、注册、上市等多个环节的需求。长期以来,以药品问题为导向的 RWS 基于药品的质量特性,研究较多的主要是 3 个方面:安全性研究、有效性研究和经济性研究。
2.1 安全性研究
百时美施贵宝公司开展过一项 RWS,回顾性使用了美国 4 个大型药品索赔数据库(Markescan、PharMetrics、Optum 和 Humana),研究纳入 2013年 1 月 1 日至 2015 年 9 月 30 日阿哌沙班或华法林的 76 940 名非瓣膜性房颤患者,并在每个数据库中对华法林-阿哌沙班倾向评分进行 1∶1 匹配后,将得到的患者记录合并,使用 Kaplan-Meier 曲线和 Cox 比例风险模型来估计开始治疗 1 年内发生卒中或全身性栓塞事件与发生严重出血事件的累积发生率和风险比,并根据阿哌沙班剂量、年龄层次、CHA2DS2-VASc 或 HAS-BLED 评分层次进行亚组分析,结果均显示,与华法林治疗相比,阿哌沙班治疗不同类型的卒中或全身性栓塞事件和大出血事件(包括缺血性卒中、出血性卒中、全身性栓塞、颅内出血、胃肠道出血和其他大出血)均显著降低 [32]。这项研究是迄今为止最大的关于阿哌沙班安全性的RWS。此项研究数据来源于真实环境,采用的控制混杂因素的方法为常用的倾向评分匹配,消除了组间不平衡特征,使结论得出更直接,也更易于解释;除此以外,还针对多因素进行了亚组分析,从多角度进一步确证研究结果,加强了可信度。
类似的大型 RWS 还有很多,例如:Strangfeld等 [33] 使用德国生物制剂注册 RABBIT 项目数据观察了 13 310 例接受托珠单抗(tocilizumab,TCZ)治疗的类风湿性关节炎患者,发现与其他生物制剂或传统合成的改善病情的抗风湿药物(DMARD)相比,使用 TCZ 治疗类风湿关节炎患者肠穿孔的风险更低。Weersink 等 [34] 为确定在真实世界的肝硬化患者队列中药物处方的流行程度和这些处方的潜在安全问题,基于来自 PHARMO 数据库网络的门诊药房数据库和住院数据库的关联数据,纳入 5 613例肝硬化患者,与团队之前对 209 种药物制定的安全建议进行了比较,结果表明肝硬化患者使用的多种药物里质子泵抑制剂和利尿剂最常用,泮托拉唑是最常用的潜在不安全药物,3 种常见非甾体抗炎药也排在前五。
药品安全性相关的 RWS 既可以出于科学目的,辅助临床决策,寻找安全可靠的治疗模式,优化个体化治疗,也可用作支持监管决策的证据来源,如药物警戒分析、上市后再评价等 [35]。同济大学医学院贺佳教授领导的研究团队 [36] 利用 FDA 不良反应报告系统(FAERS)开展了一项针对免疫检查点抑制剂(ICI)的药物警戒分析,旨在量化内分泌不良事件(AE)与 ICI 治疗的相关性,其采用 2 种基于统计收缩变换的信号指标报告优势比(ROR)和信息成分(IC)评价内分泌事件与 ICI 之间的相关性,研究共涉及 29 294 336 条记录,其中 6 260 条记录与 ICI 治疗后内分泌 AE 相关,最终药物警戒分析显示,ICI 单药治疗 [ 特别是抗细胞毒性 T 淋巴细胞相关蛋白 4(CTLA-4)治疗 ] 引起内分泌 AE 的报道频率高,联合治疗进一步加强,此外,使用不同的 ICI 免疫疗法治疗可能导致一种独特的内分泌疾病。早期识别和处理与 ICI 相关的内分泌类 AE 具有重要的意义。
2.2 有效性研究
药品上市后,真实环境下使用者数量扩大,药效是否与上市前临床试验中评价的相同,联合用药时,药效是否能稳定发挥,RWS 或许可以提供一种评价药物有效性的解决方案。
美国学者 Stenehjem 等 [37] 回顾性评估了尼鲁单抗(nivolumab)单药治疗在实际临床实践中对晚期非小细胞肺癌(NSCLC)的有效性,该研究分析的患者数据来自 Flatiron 健康肿瘤数据库中的电子健康记录,保留人口统计学、临床特征和治疗模式信息,并评估总生存期(OS)和无进展生存期(PFS),对化疗后接受尼鲁单抗治疗的非鳞状或鳞状晚期 NSCLC 患者的 OS 进行评估,并对年龄、ECOG 评分和其他基线特征进行亚组分析,Cox 回归分析用于确定 OS 预测因素。3 019 例患者中大约 20% 的患者 ECOG 评分大于 2,25% 患者年龄大于 75 岁,非鳞状上皮和鳞状上皮的中位 OS 分别为 8.6 个月(95% CI 为 8.0 ~ 9.3 个月)和 7.4 个月(95% CI 为 6.4 ~ 8.5 个月),2 个队列中,程序性死亡蛋白 1 配体 1(PD-L1)的表达为 1%,ECOG评分与较长的 OS 相关,既往接受治疗和 75 岁年龄的患者数量与 OS 无显著相关性。尼鲁单抗Ⅲ期临床试验结果显示,与多西紫杉醇相比,尼鲁单抗单药治疗显示 OS 延长且耐受性良好,这是基于排除了 ECOG 评分大于 2 分、年龄大于 75 岁且既往接受过不止 1 次的化疗患者所得出的结论,然而排除的这些群体代表了相当大比例的美国真实患者群体;而该项 RWS 证实了尼鲁单抗对既往接受过治疗的晚期 NSCLC 患者的有效性,并提示高龄和既往治疗次数与 OS 无显著相关性,较差的 ECOG 评分与较短的 OS 相关,从而为尼鲁单抗提供了关于治疗有效性的补充证据,弥补了患者群体在临床试验中代表性低的不足。
2.3 经济性研究
药品经济性研究可以了解社会医药资源的配置和利用效率,以保证有限药品发挥最大效用。RWS中也有很多开展药品经济性的研究,采用研究方法大多与常规药物经济学方法本质是一样的,核心依然是围绕成本开展成本-效果、成本-效益、成本效用、最小成本等分析方法。
我国一项研究评估了英夫利昔单抗维持治疗(IMT)中重度克罗恩病(MS-CD)的成本-效果 [38],该研究建立了一组 MS-CD 患者队列,采用传统的回归分析以比较 IMT 和常规维持治疗(CMT)在 1年观察时间内的临床结果和医疗费用,同时还构建了一个生成证据的决策分析模型,以评估 IMT 的报销成本和临床疗效。研究结果表明 IMT 在真实世界中非常有效,与 CMT 相比,IMT 有显著更高的疾病缓解机会 [ 比值比(OR)= 4.060,P = 0.003]、更低的新并发症风险(OR= 0.527,P = 0.010)、更好的生活质量(β 系数 = 0.822,P = 0.008)和更低的疾病管理相关的医院总费用(β 系数=- 0.378,P =0.008)。IMT 的成本-效果主要取决于对生活质量的评估、维持治疗的疗效、与活动性疾病相关的死亡风险以及英夫利昔单抗的单价,据估计,IMT 可使参加医保的患者花费 55 260 元获得 1 个质量调整生命年(QALY),如果支付意愿的门槛是国内生产总值(GDP)的 3 倍,则按 2018 年中国人均国内生产总值(GDPPC)计算,IMT 具有成本效益的可能性为 86.4%。这项 RWS 证实 IMT 在中国 MS-CD患者的疾病缓解率、生活质量和卫生资源利用方面均优于 CMT,与 IMT 相关的极高的疾病缓解率也提示中国患者可能对英夫利昔单抗有更好的治疗应答。另外,IMT 的成本效益具有很强吸引力。尽管其他已在中国上市的肿瘤坏死因子 -α 抑制剂(如依那西普和阿达木单抗)的维持治疗据报道比 IMT 有更高的疾病缓解率,但相对较高的成本可能使它们成为英夫利昔单抗治疗失败后的二线用药。
3 中医中药研究
辨证论治是中医药个体化诊疗取得疗效的保证,每个患者的情况皆有不同,名中医会依据经验和病证对处方自行酌情增减。中药药性的特殊性与西药化学结构式不同,很难阐明药理机制。近年来,RWS 在中医药领域快速发展,并积累了大量的经验。在技术层面,研究人员多采用数据挖掘进行相关性分析、分类和预测分析、聚类分析、进化分析等,具体来说,包括关联规则分析、复杂网络分析、决策树、人工神经网络、贝叶斯网络、支持向量机、随机漫步模型、文本挖掘等 [39]。
例如,我国一项治疗结肠癌(CC)的 RWS[40]采用关联规则技术,分析并验证包含复方苦参注射液(CKI)的处方中药物之间的相互关系,该研究的数据来源于中国中医科学院临床基础研究所建立的由 39 家三级甲等医院电子病历信息系统组成的大型集成数据仓库,并从数据仓库中的 22 家医院提取首诊为 CC 并进行 CKI 治疗的患者的电子病历报告,选取了经常与 CKI 联合使用的药物(前 20 名 )进行数据挖掘分析,分析方法采用基于 Apriori 算法的关联规则分析,并绘制了关联规则网络图,分析得出与 CKI 联合使用的中药药理机制主要有清热解毒、补气、活血化瘀、止血、调气;在现代药物中,抗生素、抗肿瘤化疗药物、免疫调节剂、5-羟色胺(5-HT)受体拮抗剂和皮质类固醇最常与 CKI 联合使用。CKI 药物组合治疗 CC 的关联规则,体现传统中药和现代西药之间存在一定规律,且通常符合CC 治疗指南,验证药物组合相互关系的 RWS 可为CKI 的合理使用提供依据。
4 讨论
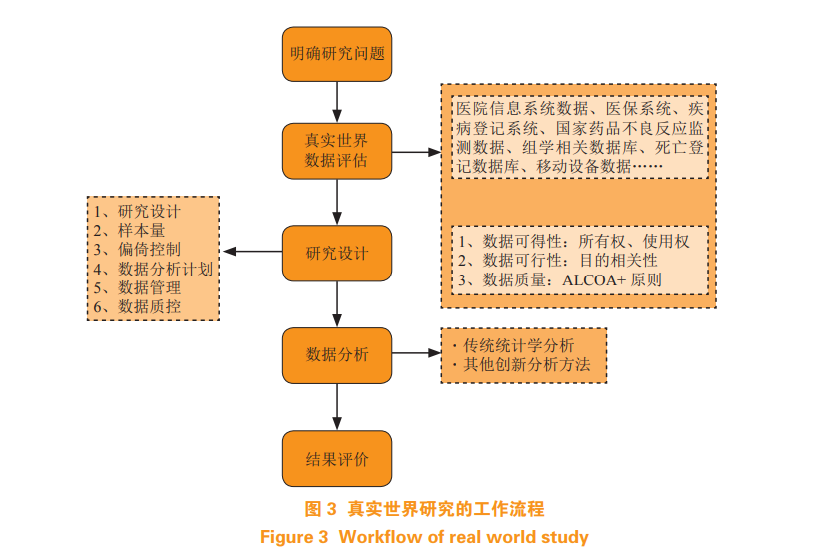
除了上述的应用举例,RWS 在医药领域还发挥着更广泛的作用,例如:合成对照组(syntheticcontrol arm)的出现辅助临床试验设计,大大节约了成本 [41];RWS 在检验医学的发展 [42],能更精准地定位患者人群;电子病历与基因组结合分析,有助发现新的生物标志物 [43];帮助发现新药适应证 [44];支持公共卫生决策 [45] 等(见图 2)。因真实世界数据量级大、种类多,许多新技术被研究人员采用,又因更接近临床实际,故分析方法上更多注重控制和减小偏倚,最常见的如倾向性匹配分析、协变量分析、敏感性分析等。无论是针对何种方向的RWS,其根本研究思路是大同小异的(见图 3),即基于一个科学问题,结合现有数据的情况,进行数据评估,确定符合研究目的后进行研究设计,依据设计执行数据分析方案,最后得到研究结果。理论转化为实际,在研究中仍需要考虑众多因素,本文对以下几点作简要讨论。
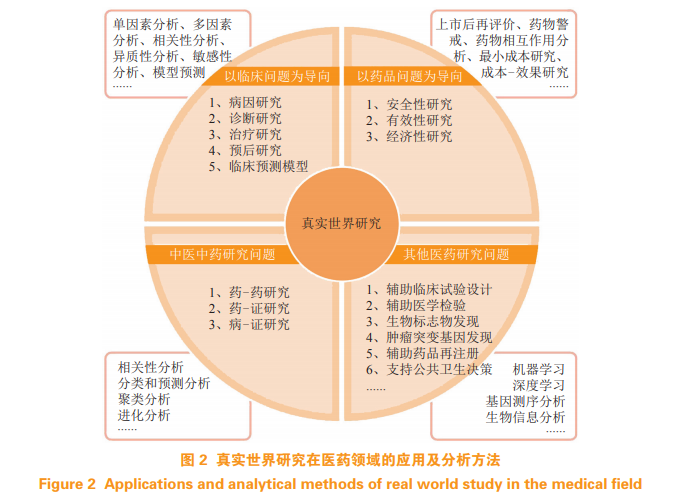
4.1 数据评估
真实世界数据来源丰富,在明确研究问题后,需要对数据进行评估,主要分为以下几点。首先,判断数据是否可得。由于数据来自于真实世界环境,如医院 HIS 系统、既往临床试验数据、或者国家药品不良反应监测系统等,需要考虑数据源的所有者,是否能取得使用权。第二,判断数据是否可行。所收集的数据是否能够进行研究,是否和研究目的相容,解决问题。第三,判断数据的质量。这里主要参考数据质量评价“ALCOA+”原则,即数据的可追溯性(attributable)、易读性(legible)、完整性(complete)、一致性(consistent)、准确性(accurate)。尤其注意随访数据的质量,关键指标是否缺失等。除此之外,还需考虑数据的安全性、个人隐私问题和伦理问题等。
4.2 研究设计
研究问题决定研究设计,没有任何一项研究设计可以适用于所有研究,只有谨慎严密的设计才会产出真实可靠的证据。RWS 的研究方法主要包括观察性研究和实验性研究。使用最广泛的设计类型是观察性研究设计,观察性研究设计又可进一步分为描述性研究和分析性研究,如病例个案报告、单纯病例、横断面研究;巢式病例对照研究、队列研究。除此之外,一些新型研究设计如注册登记研究也出现在 RWS 中。从因果推断和数据获取时间来看,RWS 又可以分为前瞻性研究和回顾性研究。各种研究设计各有优势,需要针对研究目的和数据情况择优选择。
4.3 样本量
针对不同的疾病类型和患病率,样本量有所不同。对于患病率较高的常见病、老年病、慢性病,真实环境积累了大量的病例,无论是回顾性设计还是前瞻性设计,数据量都较易得,但异质性高,样本量大,特别容易犯统计学中假设检验的一类错误,这充分考验研究者对前期数据的处理能力和统计分析方案的设计能力;而患病率较低的罕见病,以及儿童、孕妇等特殊人群所患疾病,尽管数据价值高,但研究少,样本量小,统计能力低,结果的准确性和精度非常容易受到影响,在真实世界数据的基础上适当补充一些临床试验数据,综合分析,产生的真实世界证据可能会对临床决策作出巨大贡献。
4.4 控制混杂和减小偏倚
RWS 接近临床实际情况,纳排标准比较宽泛,干扰影响因素大,人群异质性高,因此常常更注重混杂因素的控制和减小偏倚,这种控制是贯穿于整个研究过程的,而并不局限于某个特定阶段。有些混杂和偏倚通过因果推断是可以观测和预见的 [46],包括选择偏倚(例如根据疾病的严重程度和/或其他患者特征,治疗可能会有不同的处方)、信息偏倚(如数据的错误分类)、回忆偏倚(如由患者或护理人员选择性回忆有影响的事件引起)、检测偏倚(如一个事件在一个治疗组比另一个治疗组更容易被捕获等),这些在数据分析上可以通过倾向性评分、多元回归模型等方法减少和避免。而另一些在一定程度上是未知、不可预见、不可解决的偏倚,就只能在研究设计时,多加思考,谨慎处理数据,从而加以预防。
4.5 数据分析方法
依据研究目的和数据特点应尽早制定数据分析方法,RWS 的统计分析方法与大多观察性研究类似,如采用 T 检验或卡方检验进行组间比较,构建回归模型探究因素之间相关性,绘制受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)、生存曲线等。在医药大数据时代,医药图片、文本识别等机器学习、深度学习技术日趋成熟,基于各种数据库的数据分析和数据挖掘技术也已经广泛应用,尤其是在中医药领域 [39]。而 RWS 中的数据分析更多关注控制和减少偏倚,因此常会使用倾向性评分、协变量等处理方式,亦或是在经典方法上改良和创新,如先基于倾向性评分利用真实世界数据构建研究所需的对照组,再结合贝叶斯推断或复合似然函数降低信息权重 [47–48],从而更充分地利用真实世界的信息。
4.6 真实世界研究的局限性
诚然,RWS 具有其显而易见的优势,也存在一定局限性和不足,至少存在以下 3 个方面问题。首先,数据问题。真实世界数据的量级大,格式类型复杂,这需要强大的技术支持,仅靠人力完成数据清洗和分析过程将费时费力。另外,电子数据的收集可能会存在与真实不一致的情况,缺失的数据元素处理不当也会导致统计有效性降低和回答研究问题的能力下降 [49]。其次,偏倚问题。尽管 RWS 反映了真实世界人群的现实情况,佐证了临床试验结论的有效性,解决外推性问题,偏倚和混杂却是每一个 RWS 必须检查和处理的问题。RCT 的排除标准虽然可能会排除现实世界中相当大比例的患者,随机化和盲法却保证了结论的准确性。第三,证据问题。RWS 在近些年来快速发展,却并没有一个评判标准可以去衡量证据的质量,研究问题是否有价值,研究过程是否透明,终点指标是否合理,需要制定标准和规范评估。
4.7 随机对照临床试验与真实世界研究的区别与联系
长期以来,人们笃信 RCT 是验证因果关系最有效的研究方法,是检验治疗效果的金标准,其具有严格的入排标准、严谨的研究设计,再加上随机化和盲法原则控制偏倚,从而使得研究结论具有较高的内部真实性和准确性 [50]。但 RCT 的外推性较差,样本量也因疾病的不同而受限,再加上需要大量的财力、物力、人力和时间成本投入,操作性和经济性都面临多重考验。RWS的出现弥补了RCT的不足,基于真实世界环境、现实患者人群,将结论一般化,但也由于随机化的缺失和各种混杂降低了内部真实性。两者相辅相成,具有互补性,RCT 之前的 RWS可以帮助生成未来的假设,RCT 之后的 RWS 可以外推结论,进一步补充疗效证据。
5 结语
毋庸置疑,真实世界的概念广泛为临床研究者接受,RWS 掀起了全球研究的热潮。医药领域的RWS 与人类生命健康息息相关,以临床问题为导向的研究,涉及疾病的病因、诊断、治疗、预后以及临床预测模型等诊疗流程的各个阶段,这其中任何一个环节问题的解决和改善都将大大提高患者的生活质量和健康水平。在药品研究中,RWS 同样发挥着的重要作用,尤其是药品上市后的监管问题。RWS 可以为药品注册上市提供安全性和有效性证据,可以为上市后再评价提供补充材料,可以发现早期药物警戒的信号,还可以开展药品经济学研究,了解社会医药资源的配置和利用效率。在中医药领域,RWS 多用于评价中西结合的处方以及经典名方、复方制剂的有效性和安全性,或分析“药-药”、“药-证”、“病-证”之间的关联性。研究方法上,RWS 使用最广泛的观察性研究,统计分析方法与传统临床研究本质上是一样的,但重点需要关注偏倚和混杂因素的控制。从研究需求来看,RWS 并不是一种新的研究方式,也不是 RCT 的替代品,RWS是一种循证的补充,是人们期望在非严格的 RCT 条件之外,在真实医疗环境下,寻找更多的证据和线索来解决实际问题。
总而言之,未来 RWS 的潜力巨大,可解决的问题和适用的领域也将更广,我们期待有更好的设计和分析方法能够被发现、调整和应用,RWS 局限和问题能够得到更好的解决。
参考文献



